باتری خودرو – بخش اول
مقدمه
براي استفاده از برخي وسايل الكتريكي خودرو مانند راديو و پخش، هنگامي كه موتور خودرو خاموش است بايد از يك منبع تغذيه جريان مستقيم استفاده نمود. علاوه بر اين، تمامي خودروها داراي راه انداز الكتريكي (استارتر) مي باشند كه براي تأمين برق مورد نياز آن به يك باتري نياز است همچنين امروزه استفاده از دستگاههای الكترونيكي در خودروها رو به افزايش بوده و اين سيستمها معمولاً نسبت به نوسانات ولتاژ حساس مي باشند و با معيوب شدن باتری و سيستم شارژ، كار خودرو نيز دچار مشكل ميشود.
در اين صورت از باتری خودرو مي توان به عنوان يك عنصر كليدی در مدارات برقی خودرو نام برد و به لحاظ كاربرد زياد و اهميت آن در اين فصل به طور مفصل در مورد باتريهاي مورد استفاده در خودرو و به خصوص باتری سربي- اسيدی بحث شده است.
با توجه به موارد فوق لازم است قبل از بررسي هر مدار، انواع آزمايشها و روشهاي تست باتری را ياد گرفته تا در صورت بروز مشكل در مدارات برقي خودرو، ابتدا كليدي ترين عنصر مدار يا باتری را از لحاظ وجود عيب بررسي نموده، در صورت بي عيب بودن باتری، قسمتهای ديگر مدار بررسي گردد.
وظيفه باتری خودرو
باتری دستگاهي است كه انرژی شيميايي را به انرژی الكتريكي تبديل مي كند. وظيفه باتری خودرو اين است كه در لحظه روشن نمودن موتور خودرو و همچنين هنگامي كه موتور خودرو خاموش است يا دور موتور پايين است نيازهای الكتريكي خودرو مانند استارت زدن، استفاده از راديو، لامپها، شيشه بالابرها و … را برآورده سازد.
انواع باتری خودرو
انواع دسته بندی باتری های ثانويه:
باتري های ثانويه به روش های گوناگوني دسته بندی مي شوند، كه مهمترين آنها در ادامه آمده است.
دسته بندی باتری ها از نظر جنس مواد تشكيل دهنده:
اين روش مهمترين نوع دسته بندي باتري ها به شمار مي رود. در واقع با دانستن نوع مواد تشكيل دهنده يك باتري مي توان به خصوصيات كلي آن باتري پي برد. معروف ترين باتری ها از اين نقطه نظر عبارتند از:
باتری سربی- اسيدی، باتری نيكل- كادميوم (آلكالاين)، باتري سديم- گوگرد و باتري نيكل- آهن در جدول (1) برخي از انواع باتري ها را از نظر ولتاژ توليدي هر خانه با هم مقايسه كرده است.
| نوع باتري | ولتاژ هر خانه باتري | احتياج به نگهداري |
| سربي- اسيدي | V2 | اگر از ژل به عنوان الكتروليت استفاده شود نياز به نگهداري ندارد |
| نيكل- كادميم | V2/1 | دارد |
| نيكل- آهن | V2/1 | دارد |
| سديم- گوگرد | V2/1 | ندارد |
جدول 1- مقايس چند نوع باتری مورد استفاده در خودرو
دسته بندی باتريها از نظر حالت الكتروليت:
باتری هایی که الكتروليت آنها جامد است (الكتروليت مانند ژل است) باتری های خشك و باتری هايي كه الكتروليت آنها مايع است باتری های تر ناميده مي شوند.
توجه: در گروه خاصي از باتري ها، الكتروليت به صورت گاز به داخل باتري وارد شده و پس از انجام واكنش شيميايي مربوطه از باتري خارج مي شوند. به اين نوع باتريها، پيل سوختي مي گويند كه معروفترين آنها پيل سوختي هيدروژن مي باشد كه هيدروژن را از منبع هيدروژن و اكسيژن را از هواي اطراف كه به نحوي وارد باتری ميشود دريافت مي كند.
به جز اين دو روش دسته بندی، روش های ديگری نيز وجود دارد مثلاً دسته بندی از نظر:
- ولتاژ توليدی
- قابليت شارژ مجدد
- قابليت تغيير پذيری و سايز
كه نسبت به دو روش ذكر شده از درجه اهميت كمتری برخوردار هستند.
باتری خودروها معمولاً از نوع سربي- اسيدی بوده و از نظر حالت الكتروليت نوع تر و خشك آن وجود دارد ولتاژ آن 12 ولت و قابليت شارژ مجدد را دارا بوده و در سايزهاي مختلف توليد مي شوند.
طرز كار باتری سربی- اسيدی
هرگاه دو فلز غير همجنس درون محلول اسيدي يا الكتروليت قرار گيرند، جريان برق توليد مي شود. به طوري كه يكي از اين دو فلز الكترون مي دهد (صفحة منفي) و ديگري الكترون مي گيرد (صفحه مثبت).
ميزان برق توليدي يا ولتاژ برق توليدي بستگي به جنس دو فلز و نوع الكتروليت دارد. جدول (2) قدرت الكترونگيري يا الكتروندهي چند فلز را نسبت به هيدروژن نشان مي دهد. اعداد منفي به معني دهندة الكترون و اعداد مثبت به معني گيرندة الكترون مي باشد.
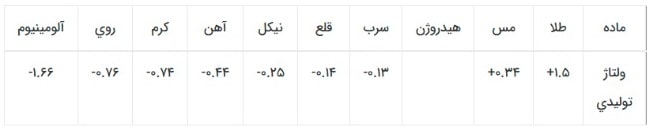 جدول 2- ولتاژ توليدي برخي فلزات نسبت به هيدروژن (قدرت الكتروندهي يا الكترونگيري)
جدول 2- ولتاژ توليدي برخي فلزات نسبت به هيدروژن (قدرت الكتروندهي يا الكترونگيري)
اگر دو فلز غير همجنس طلا و آلومينيم به عنوان صفحات باتري انتخاب شوند بيشترين مقدار برق توليد مي گردد:
![]()
ولي به دليل كميابي و گران بودن اين فلزات، ترجيح داده مي شود كه از فلزات ارزانتر، فراوانتر و مقاومتر در مقابل خوردگي الكتروليت استفاده گردد و از اينرو با انجام اعمال شيميايي روي فلز سرب، از اين فلز در باتري هاي خودرو استفاده مي گردد. در اين باتري ها از محلول آب مقطر و اسيد سولفوريك به عنوان الكتروليت استفاده مي شود.
با توجه به مطالب فوق و شكل (1) اگر دو فلز غير همجنس، يكي از جنس سرب (pb) به عنوان صفحة منفي و ديگري از جنس دياكسيد سرب (pbo2) به عنوان صفحه مثبت در محلول آب (H2o) و اسيد سولفوريك (H2SO4) قرار گيرد، باتري سربي- اسيدی تشكيل مي شود كه حداكثر 2/2 ولت برق توليد مي كند.
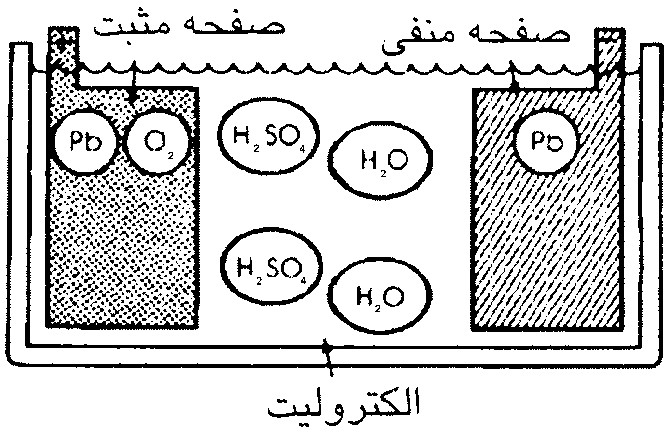
شكل 1- تشكيل باتری سربي اسيدی در حالت شارژ كامل
اگر مطابق شكل (2) از اين باتري استفاده شده و برق آن مورد مصرف قرار گيرد به تدريج سولفات (SO4) از الكتروليت جدا شده و به صفحة مثبت و منفي مي چسبد و از طرفي اكسيژن (O2) صفحة مثبت نيز از اين صفحه جدا شده و وارد الكتروليت مي شود.
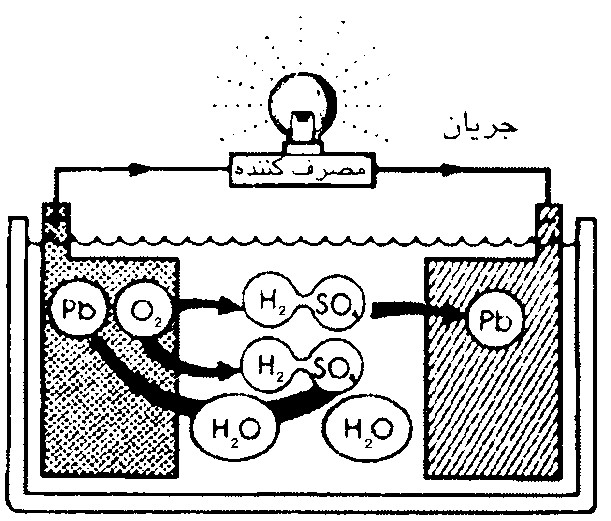
شكل 2- روند دشارژ باتري سربي- اسيدي
در اين حالت فعل و انفعالات شيميايي باتري به صورت زير مي باشد:
ابتدا محلول الكتروليت كه اسيد سولفوريك رقيق مي باشد تجزيه مي شود:
![]()
موازنة (1)
موازنه شيميايي بر روي صفحات مثبت انجام مي شود.
![]()
موازنة (2)
با توجه به موازنه هاي بالا، موازنة شيميايي نهايي صفحات مثبت در هنگام دشارژ كامل باتري، مطابق موازنة (4-6) انجام مي شود:
![]()
موازنة (3)
بنابراين در هنگام دشارژ كامل باتري، جنس صفحات مثبت PbSO4 مي باشد.
در روند دشارژ باتري، موازنة شيميايي بر روي صفحات منفي نيز با توجه به موازنة (4) انجام مي شود.
![]()
موازنة (4)
از اينرو، موازنه نهايي صفحات منفي در هنگام دشارژ كامل باتري، با توجه به موازنه هاي (1) و (2) مطابق موازنة (5) مي باشد.
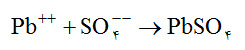
موازنة (5)
بنابراين در هنگام دشارژ كامل باتری، جنس صفحات منفي نيز PbSO4 ميباشد.
در اينصورت موازنة مايع الكتروليت نيز در حالت دشارژ كامل باتري، با توجه به موازنه هاي (1) و (2) مطابق موازنة (6) مي باشد.
![]()
موازنة (6)
بنابراين در حالت دشارژ كامل باتري، جنس صفحة مثبت و منفي به سولفات سرب (PbSO4 ) و الكتروليت به آب تبديل مي شود. اين موضوع در شكل (3-6) ملاحظه مي شود.
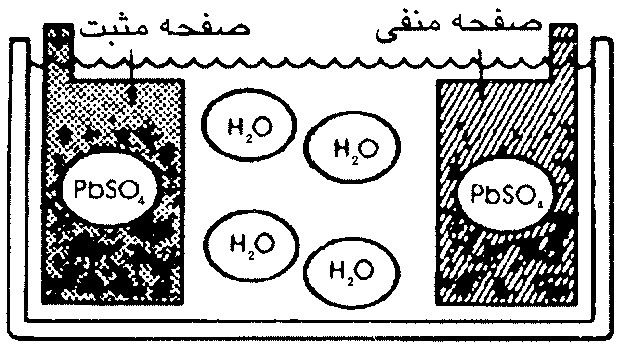
شكل 3- باتري سربي- اسيدي در حالت دشارژ يا تخليه کامل
براي آنكه دوباره بتوان از اين باتري استفاده نمود، بايد باتري را به دستگاه شارژ باتري، دينام يا آلترناتور خودرو وصل نمود تا مطابق شكل (4-6) جنس صفحة مثبت به دي اكسيد سرب (PbO2)، جنس صفحة منفي به سرب (Pb) و جنس الكتروليت به اسيد سولفوريك (H2SO4) تبديل گردد.
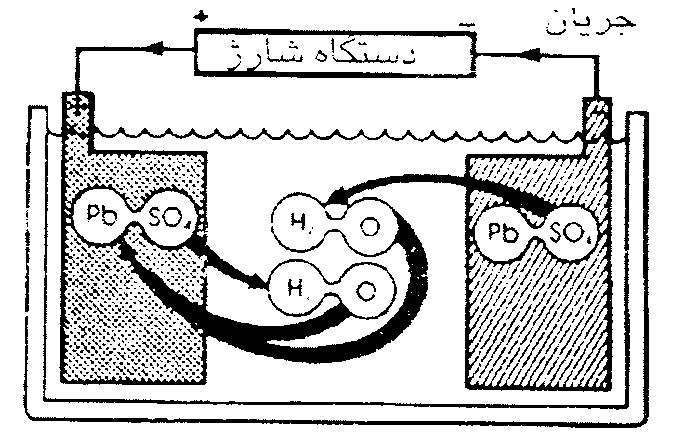
شكل 4- روند شارژ باتري سربي- اسيدي
به عبارتي ديگر شارژ باتري روندي است كه سولفات هاي (SO4) چسبيده شده به صفحة مثبت و منفي از صفحات جدا شده و وارد الكتروليت مي گردند و اكسيژن (O2) وارد شده از صفحة مثبت به الكتروليت، به صفحة مثبت باز مي گردد.
نویسنده مهندس صیاد نصیری






